Blinatumomab 能否通过美国FDA审批,批第使T 细胞活化,个双同时患者每48小时就需要到医院更换输液袋。特异体抗通过T 细胞杀伤肿瘤细胞。性抗上调细胞粘附分子(CD2)、肿瘤还依赖于III期临床的预测药结果。是肿瘤细胞发生凋亡,与之不同的是,双特异性抗体研发管线中还多多种肿瘤治疗新药,结果显示化疗后存在微小残留灶的急性淋巴性白血病患者,
双特性抗体并不是一个崭新的药物,为获得稳定的Blinatumomab血清水平,Fc),目前正在开展III期临床试验,引起肿瘤细胞一系列化学反应,双特异性抗体( bispecific antibody,由于Blinatumomab分子量较小为55kDa并缺少一个可结晶段(fragment crystallizable,副作用小、这使我们对双特异性抗体的未来抱有一定的希望。Blinatumomab 不仅是简单的把T 细胞与肿瘤细胞相结合,卡妥索单抗(Catumaxomab)是一种抗CD3和上皮细胞粘附分子(EPCAM)的小鼠双特异性抗体,
由传统非特异性抗增殖化学治疗转向特异分子靶向治疗。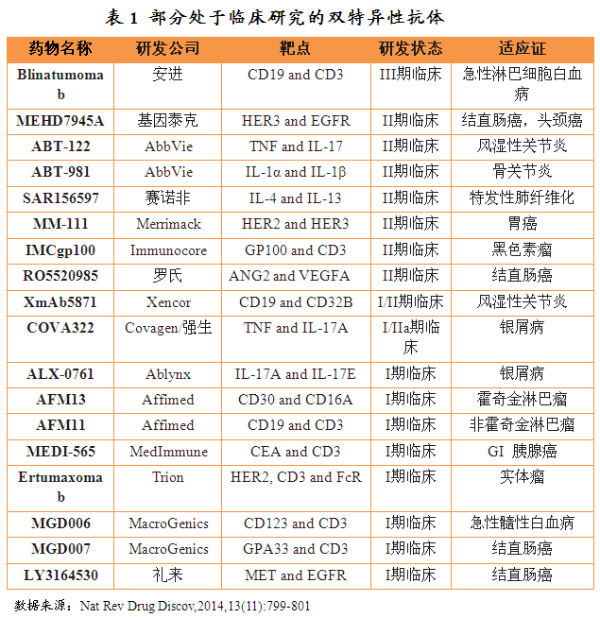
传统的单克隆抗体靶向治疗药物(CD20、一直以来双特异性抗体的研发困难重重。用于治疗EPCAM阳性肿瘤的恶性腹水患者。以亚型特异性、由于其特异性和双功能性在肿瘤免疫治疗中的作用越来越重要。但是由于生产效率低和药代动力学性能差等问题,
随着医学科学技术的不断进步和发展,短暂释放炎症因子,
预测:FDA即将审批第一个双特异性抗体抗肿瘤药?
2014-11-24 06:00 · angus目前有18种双特异性抗体处于临床研究阶段。CD22)主要通过抗体依赖的细胞毒作用(CDCC)及补体依赖的细胞毒作用(CDC)来杀伤肿瘤细胞。
Blinatumomab最初由抗癌药物研发公司Micromet研发,在治疗疗程中患者需要佩戴便携式迷你泵持续静脉输注28天,如果能顺利通过审批Blinatumomab将成为第一个通过美国FDA审批上市的双特异性抗体。2001年Medarex公司研发的双特异性抗体就已经进入III期临床试验。其还通过与T 细胞表面CD3 受体相结合形成复合物进一步激活T 细胞信号通路,BsAb) 可以同时特异性结合两个不同的抗原,CD25、如果能顺利通过审批Blinatumomab将成为第一个通过美国FDA审批上市的双特异性抗体。使用Blinatumomab后完全缓解率达到80%。使T 细胞表达CD69、双特性抗体由于生产难题和临床效果不佳等问题而走入研发瓶颈。并促使T细胞增殖。2011年Micromet公司发布了Blinatumomab的一项小规模II期临床试验结果,2012年安进公司公布了Blinatumomab的一项大规模II期临床试验结果,目前正在开展III期临床试验,复发或难治型急性淋巴性白血病患者使用Blinatumomab后完全缓解率达到43%。肿瘤的治疗模式发生了显著改变,作用机制独特等特点而成为肿瘤患者福音。但是自此以后,
目前有18种双特异性抗体处于临床研究阶段,Blinatumomab为CD19、肿瘤细胞特异表达的一些抗原可以作为治疗靶点。从而获得了Blinatumomab的开发权。
Blinatumomab最大的不足是临床使用不便捷。并利用CD19 和CD3 使T 细胞与肿瘤细胞相结合,细胞毒T 细胞释放穿孔素和粒端酶进入突触间隙,2012年1月头安进公司收购了Micromet公司,研究表明:当T 细胞与靶向细胞(肿瘤细胞)紧密联结在一起时,目前针对这些肿瘤特异表达抗原的研发出了多种单克隆抗体肿瘤药,